Oferta
Popularne tagi
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie WszystkieSul-Tridin 24%, 200 mg/ml + 40 mg/ml
1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny:
ScanVet Poland Sp. z o.o.,
Skiereszewo, ul. Kiszkowska 9,
62-200 Gniezno
Wytwórca odpowiedzialny za zwolnienie serii:
Norbrook Laboratories Ltd.
Station Works, Camlough Road,
Newry, Co. Down
BT35 6JP Irlandia Północna
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
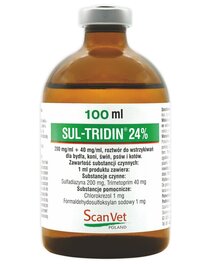
Sul-Tridin 24%, 200 mg/ml + 40 mg/ml, roztwór do wstrzykiwań dla bydła, koni, świń, psów i kotów
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
1 ml preparatu zawiera:
Substancje czynne:
sulfadiazyna 200 mg
trimetoprim 40 mg
Substancje pomocnicze:
chlorokrezol 1 mg
formaldehydosulfoksylan sodowy 1 mg
N-metylopirolidon 0,500 ml
4. WSKAZANIA LECZNICZE
Ostre i przewlekłe infekcje wywołane przez drobnoustroje wrażliwe na sulfadiazynę i trimetoprim, dotyczące układu oddechowego, układu moczowego, rozrodczego, przewodu pokarmowego, zanokcicy, ciężkich przypadków mastitis itp.
Spektrum działania preparatu obejmuje bakterie:
Gram dodatnie: Actinomyces spp., Corynebacterium spp., Pneumococcus spp., Staphylococcus spp., Streptococcus spp.
Gram ujemne: Actinobacillus spp., Bordetella spp., Brucella spp., Escherichia coli, Haemophilus spp., Klebsiella spp., Pasteurella spp., Proteus spp., Salmonella spp., Vibrio spp.
5. PRZECIWWSKAZANIA
Nie stosować w przypadku nadwrażliwości na substancję czynną, inne sulfonamidy lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt ze schorzeniami wątroby lub dyskrazją krwi.
Nie podawać inną drogą niż zalecana, nie podawać dootrzewnowo, dotętniczo, dooponowo.
6. DZIAŁANIA NIEPOŻĄDANE
Po podaniu dożylnym mogą wystąpić reakcje anafilaktyczne, szczególnie u koni.
Po podaniu produktu u zwierząt mogą wystąpić zaburzenia rytmu serca.
W bardzo rzadkich przypadkach, po podaniu sulfadiazyny i trimetoprimu u psów, obserwowano wystąpienie zapalenia rogówki i spojówki.
O wystąpieniu działań niepożądanych po podaniu tego produktu lub zaobserwowaniu jakichkolwiek niepokojących objawów nie wymienionych w ulotce (w tym również objawów u człowieka na skutek kontaktu z lekiem), należy powiadomić właściwego lekarza weterynarii, podmiot odpowiedzialny lub Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i produktów Biobójczych. Formularz zgłoszeniowy należy pobrać ze strony internetowej http://www.urpl.gov.pl (Pion Produktów Leczniczych Weterynaryjnych).
7. DOCELOWE GATUNKI ZWIERZĄT
Koń, bydło, świnia, pies, kot
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
Bydło, świnie: podawać domięśniowo lub powoli dożylnie
Zalecana dawka wynosi 15 mg substancji czynnych na kilogram masy ciała zwierzęcia (1 ml/16 kg m.c.). W cięższych przypadkach można stosować dawkę 1 ml/10 kg m.c. Sul-Tridin 24% można podawać dożylnie, gdy wymagane jest szybkie uzyskanie odpowiednich stężeń sulfadiazyny i trimetoprimu we krwi.
Konie: podawać powoli dożylnie
Zalecana dawka wynosi 15 mg substancji czynnych na kilogram masy ciała zwierzęcia (1 ml/16 kg m.c.). W cięższych przypadkach można stosować dawkę 1 ml/10 kg m.c.
Psy i koty: podawać podskórnie
Zalecana dawka wynosi 30 mg substancji czynnych na kilogram masy ciała zwierzęcia (1 ml/8 kg m.c.). U psów zaleca się podawanie preparatu w skórę w okolicy grzbietowej szyi. W nieskomplikowanych przypadkach może wystarczyć jednorazowe podanie preparatu. W większości zakażeń preparat należy podawać raz dziennie przez okres 2 dni od momentu ustąpienia objawów choroby nie dłużej jednak niż przez okres 5 dni.
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Przed podaniem drogą dożylną lek należy podgrzać do temperatury ciała i podawać bardzo powoli.
10. OKRES KARENCJI
Tkanki jadalne: bydła – 8 dni, świń – 15 dni.
Mleko krowie – 48 godzin.
Nie stosować u koni, których tkanki przeznaczone są do spożycia przez ludzi.
Konie kiedykolwiek leczone produktem Sul-Tridin 24% nie mogą zostać przeznaczone do uboju w celu spożycia przez ludzi.
Stosować wyłącznie u koni, które w paszporcie mają podpisaną deklarację „nie jest przeznaczony do uboju w celach spożywczych (konsumpcji przez ludzi) zgodnie z obowiązującym prawem”
11. SZCZEGÓLNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać w temperaturze poniżej 25°C.
Chronić przed światłem.
Przy przechowywaniu w niskiej temperaturze może dojść do odwracalnej krystalizacji roztworu.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie.
Zawartość otwartego opakowania należy zużyć w ciągu 28 dni.
12. SPECJALNE OSTRZEŻENIA
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Przed podaniem drogą dożylną lek należy podgrzać do temperatury ciała i podawać bardzo powoli.
Podczas leczenia zwierzętom należy zapewnić stały dostęp do wody pitnej.
Podczas podawania leku należy uważnie obserwować zwierzę, a w przypadku zauważenia pierwszych objawów wstrząsu natychmiast zaprzestać podawania leku i rozpocząć leczenie przeciwwstrząsowe.
Po podaniu dożylnym mogą wystąpić reakcje anafilaktyczne, szczególnie u koni.
Produkt powinien być stosowany w oparciu o wyniki testu oporności bakterii wyizolowanych od chorych zwierząt. Jeśli nie jest to możliwe, leczenie powinno być prowadzone w oparciu o lokalne informacje epidemiologiczne dotyczące wrażliwości izolowanych bakterii.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Należy zachować ostrożność aby uniknąć przypadkowej samoiniekcji lub kontaktu produktu ze skórą.
Po użyciu umyć ręce.
Suflonamidy mogą wywołać nadwrażliwość (alergię) po wstrzyknięciu, wdychaniu, spożyciu lub kontakcie ze skórą. Nadwrażliwość na sulfonamidy może prowadzić do reakcji krzyżowej z innymi antybiotykami. Reakcje alergiczne na te substancje mogą być sporadycznie poważne.
Osoby o znanej nadwrażliwości na sulfonamidy powinny unikać kontaktu z tym produktem leczniczym weterynaryjnym. W przypadku zauważenia takich objawów jak wysypka skórna należy zwrócić się o pomoc lekarską i okazać niniejsze ostrzeżenie.
Ciąża:
Może być stosowany w okresie ciąży.
Laktacja:
Może być stosowany w okresie laktacji.
Bezpieczeństwo produktu leczniczego weterynaryjnego u bydła, koni, świń, psów i kotów w czasie ciąży, laktacji lub u zwierząt przeznaczonych do hodowli nie zostało określone. W badaniach laboratoryjnych na królikach i szczurach z zastosowaniem substancji pomocniczej N-metylopirolidonu wykazano cechy działania szkodliwego dla płodu. Lek należy stosować jedynie po dokonaniu przez lekarza weterynarii oceny stosunku korzyści do ryzyka.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Nie stosować łącznie z preparatami zawierającymi witaminy z grupy B lub kwas foliowy lub jego analogi.
Nie stosować łącznie z penicyliną prokainową.
Należy zachować ostrożność podczas podawania produktu równocześnie z fenylobutazonem, salicylanami oraz fenytoiną.
Nie stosować u koni, u których występują arytmie serca spowodowane lekami. Takie arytmie mogą pojawić się w skutek podania niektórych środków do sedacji lub anestetyków.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
Z danych dotyczących badań przeprowadzonych na zwierzętach laboratoryjnych wynika, że długotrwałe podawanie sulfadiazyny i trimetoprimu w zawiesinie wodnej, w dawce 5000 mg/kg m.c. skutkowało jedynie zmianami masy tarczycy i przysadki.
W badaniach polegających na dożylnym podawaniu kombinacji sulfadiazyny i trimetoprimu koniom, w dawkach dwukrotnie i trzykrotnie przekraczających dawkę zalecaną przez okres 7 dni, a także w dawce dwukrotnie przekraczającej dawkę zalecaną przez okres 21 dni, nie zaobserwowano żadnych objawów działania toksycznego.
Niezgodności farmaceutyczne:
Ponieważ nie wykonano badań dotyczących zgodności, produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia bezużytecznych leków zapytaj lekarza weterynarii. Pozwolą one na lepszą ochronę środowiska.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
04/2023
15. INNE INFORMACJE
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z podmiotem odpowiedzialnym:
ScanVet Poland Sp. z o.o.,
Skiereszewo,
ul. Kiszkowska 9,
62-200 Gniezno,
Tel. 61 426 49 20
Pozwolenie nr 803/99