Oferta
Popularne tagi
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie WszystkieThyrasol
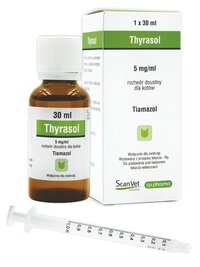
Thyrasol 5 mg/ml, roztwór doustny dla kotów
1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii:
CP-Pharma Handelsgesellschaft mbH
Ostlandring 13
31303 Burgdorf
Niemcy
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Thyrasol 5 mg/ml, roztwór doustny dla kotów
Tiamazol
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
Substancja aktywna:
Tiamazol 5,0 mg/ml
Substancje pomocnicze:
Sodu benzoesan (E 211) 1,5 mg/ml
Bezbarwny lub jasnobrunatny, mętny, lepki roztwór.
4. WSKAZANIA LECZNICZE
Do stabilizacji nadczynności tarczycy u kotów przed zabiegiem tyroidektomii.
Do długotrwałego leczenia nadczynności tarczycy u kotów.
5. PRZECIWWSKAZANIA
Nie stosować u kotów cierpiących na choroby ogólnoustrojowe, takie jak pierwotna choroba wątroby lub cukrzyca.
Nie stosować u kotów wykazujących objawy choroby autoimmunologicznej.
Nie stosować u zwierząt z zaburzeniami krwinek białych, takimi jak neutropenia i limfopenia.
Nie stosować u zwierząt z zaburzeniami płytek krwi i koagulopatiami (w szczególności małopłytkowością).
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Nie stosować w okresie ciąży lub laktacji.
Informacje dotyczące stosowania w okresie ciąży lub laktacji podano w części SPECJALNE OSTRZEŻENIA.
6. DZIAŁANIA NIEPOŻĄDANE
Działania niepożądane były zgłaszane po długotrwałym leczeniu nadczynności tarczycy. W wielu przypadkach objawy mogą być łagodne i przemijające i nie stanowią powodu do przerwania leczenia. Poważniejsze skutki są w większości odwracalne po odstawieniu leku.
Działania niepożądane są rzadkie. Do najczęściej zgłaszanych klinicznych działań niepożądanych należą wymioty, brak apetytu / anoreksja, utrata masy ciała, letarg, silny świąd, przeczosy głowy i szyi, skaza krwotoczna, żółtaczka związana z hepatopatią oraz nieprawidłowości hematologiczne (eozynofilia, limfocytoza, neutropenia, limfopenia, niewielka leukopenia, agranulocytoza, trombocytopenia lub niedokrwistość hemolityczna). Te działania niepożądane ustępują w ciągu 7–45 dni po zaprzestaniu leczenia tiamazolem.
Możliwe immunologiczne skutki uboczne obejmują anemię, z rzadkimi skutkami ubocznymi, w tym trombocytopenią i przeciwciałami przeciwjądrowymi w surowicy, a bardzo rzadko może wystąpić powiększenie węzłów chłonnych. W takich przypadkach leczenie należy natychmiast przerwać i rozważyć alternatywną terapię po odpowiednim okresie rekonwalescencji.
Wykazano, że po długotrwałym leczeniu tiamazolem u gryzoni występuje zwiększone ryzyko rozwoju nowotworu tarczycy, ale nie ma dowodów na to u kotów.
Częstotliwość występowania działań niepożądanych jest określona przy użyciu następującej konwencji:
- bardzo często (więcej niż 1 na 10 leczonych zwierząt – wykazujących działania niepożądane)
- często (więcej niż 1, ale mniej niż 10 zwierząt na 100 leczonych zwierząt)
- niezbyt często (więcej niż 1, ale mniej niż 10 zwierząt na 1000 leczonych zwierząt)
- rzadko (więcej niż 1, ale mniej niż 10 zwierząt na 10 000 leczonych zwierząt)
- bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, w tym pojedyncze zgłoszenia).
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania:
Departament Oceny Dokumentacji i Monitorowania Niepożądanych Działań Produktów Leczniczych Weterynaryjnych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, PL-02-222 Warszawa, Polska
Tel.: +48 22 49-21-687 Faks: +48 22 49-21-605
https://urpl.gov.pl
7. DOCELOWE GATUNKI ZWIERZĄT
Koty.
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
W celu stabilizacji nadczynności tarczycy u kotów przed zabiegiem tyroidektomii oraz do długotrwałego leczenia nadczynności tarczycy u kotów, zalecana dawka początkowa wynosi 5 mg (= 1 ml produktu) na dobę.
W miarę możliwości całkowitą dawkę dobową należy podzielić na dwie części i podawać rano i wieczorem.
Dawkę należy podawać bezpośrednio do jamy ustnej za pomocą strzykawki.
Podanie doustne.
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Jeżeli, ze względu na zalecenia terapeutyczne, preferowane jest dawkowanie raz dziennie, jest to dopuszczalne, chociaż dawka 2,5 mg (= 0.5 ml produktu) podawana dwa razy dziennie może być bardziej skuteczna w krótkim okresie.
Badanie hematologiczne, biochemiczne i badanie całkowitej T4 w surowicy należy przeprowadzić przed rozpoczęciem leczenia oraz po 3 tygodniach, 6 tygodniach, 10 tygodniach, 20 tygodniach, a następnie co 3 miesiące. W każdym z zalecanych odstępów obserwowania dawkę należy dostosowywać w zależności od efektu w zależności od całkowitej T4 i odpowiedzi klinicznej na leczenie. Standardowe dostosowanie dawki powinno być dokonywane w krokach co 2,5 mg, a celem powinno być osiągnięcie możliwie najniższej dawki.
Jeśli wymagane jest więcej niż 10 mg na dobę, zwierzęta należy szczególnie uważnie obserwować.
Podawana dawka nie powinna przekraczać 20 mg/dobę.
W przypadku długotrwałego leczenia nadczynności tarczycy zwierzę powinno być leczone do końca życia.
10. OKRES(-Y) KARENCJI
Nie dotyczy.
11. SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie.
Termin ważności oznacza ostatni dzień danego miesiąca.
12. SPECJALNE OSTRZEŻENIA
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
W celu poprawy stabilizacji pacjenta z nadczynnością tarczycy należy codziennie stosować ten sam schemat żywienia i dawkowania.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Jeśli wymagane jest więcej niż 10 mg tiamazolu na dobę, zwierzęta należy szczególnie uważnie obserwować.
Ponieważ tiamazol może powodować zagęszczenie krwi, koty powinny mieć zawsze dostęp do wody pitnej.
Stosowanie produktu u kotów z zaburzeniami czynności nerek powinno być poddane przez lekarza dokładnej ocenie stosunku korzyści do ryzyka. Ze względu na wpływ, jaki tiamazol może wywierać na zmniejszenie szybkości przesączania kłębuszkowego, należy ściśle obserwować wpływ leczenia na czynność nerek, ponieważ może wystąpić pogorszenie podstawowych zaburzeń ich czynności.
Należy monitorować hematologię ze względu na ryzyko leukopenii lub niedokrwistości hemolitycznej.
Każde zwierzę, które nagle źle się poczuje podczas terapii, szczególnie jeśli wystąpi gorączka, powinno mieć pobraną próbkę krwi do rutynowego badania hematologicznego i biochemicznego.
Zwierzęta z neutropenią (liczba neutrofili < 2,5 x 109/l) należy leczyć profilaktycznie bakteriobójczymi lekami przeciwbakteryjnymi i w razie potrzeby, terapią wspomagającą, po dokonaniu przez lekarza weterynarii oceny bilansu korzyści do ryzyka.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Osoby o znanej nadwrażliwości (alergii) na tiamazol lub którąkolwiek z substancji pomocniczych powinny unikać kontaktu z produktem leczniczym weterynaryjnym. W przypadku wystąpienia objawów alergicznych, takich jak wysypka skórna, obrzęk twarzy, ust lub oczu lub trudności w oddychaniu, należy natychmiast zwrócić się o pomoc lekarską i pokazać lekarzowi ulotkę dołączoną do opakowania lub etykietę.
Niniejszy produkt może powodować podrażnienie skóry i/lub oczu. Unikać kontaktu ze skórą i oczami, w tym kontaktu rąk z oczami.
W razie przypadkowego kontaktu ze skórą i/lub oczami natychmiast przemyć skórę i/lub oczy czystą bieżącą wodą. W razie wystąpienia podrażnienia zasięgnąć porady lekarza.;
Po podaniu produktu i przy kontakcie z wymiocinami lub żwirkiem stosowanym przez leczone zwierzęta umyć ręce wodą z mydłem.
Tiamazol może powodować zaburzenia żołądkowo-jelitowe, ból głowy, gorączkę, ból stawów, świąd (swędzenie) i pancytopenię (zmniejszenie liczby krwinek i płytek krwi).
Unikać narażenia doustnego, w tym kontaktu rąk z ustami.
Podczas kontaktu z produktem lub zużytym żwirkiem nie jeść, nie pić i nie palić.
W razie przypadkowego połknięcia niezwłocznie zasięgnąć porady lekarza i pokazać lekarzowi ulotkę dołączoną do opakowania lub etykietę.
Nie pozostawiać napełnionych strzykawek bez nadzoru.
Po podaniu produktu wszelkie pozostałości produktu znajdujące się na końcu strzykawki dozującej należy wytrzeć chusteczką. Zanieczyszczoną chusteczkę należy natychmiast zutylizować.;
Strzykawkę używaną do podawania produktu należy przechowywać wraz z produktem w oryginalnym pudełku.
Ponieważ istnieje podejrzenie, że tiamazol ma działanie teratogenne u ludzi, kobiety w wieku rozrodczym muszą nosić nieprzepuszczalne rękawiczki jednorazowego użytku podczas podawania produktu lub dotykania żwirku/wymiocin leczonych kotów.
W przypadku ciąży lub podejrzenia ciąży lub w przypadku prób zajścia w ciążę, nie należy podawać produktu ani dotykać żwirku/wymiocin leczonych kotów.
Ciąża i laktacja:
Nie stosować w okresie ciąży lub laktacji.
Badania laboratoryjne na szczurach i myszach wykazały dowody na teratogenne i embriotoksyczne działanie tiamazolu. Bezpieczeństwo produktu nie zostało ocenione u kotek w ciąży lub karmiących.;
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Jednoczesne leczenie fenobarbitalem może zmniejszać skuteczność kliniczną tiamazolu.
Wiadomo, że tiamazol zmniejsza oksydację wątrobową środków odrobaczających na bazie benzimidazolu i może prowadzić do zwiększenia ich stężenia w osoczu, gdy jest podawany jednocześnie.
Tiamazol ma działanie immunomodulujące; należy to wziąć pod uwagę przy rozważaniu programów szczepień.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
W badaniach tolerancji u młodych zdrowych kotów przy dawkach do 30 mg tiamazolu/zwierzę/dobę wystąpiły następujące objawy kliniczne zależne od dawki: jadłowstręt, wymioty, letarg, świąd oraz nieprawidłowości hematologiczne i biochemiczne, takie jak neutropenia, limfopenia, zmniejszone stężenie potasu i fosforu w surowicy, podwyższony poziom magnezu i kreatyniny oraz występowanie przeciwciał przeciwjądrowych. Przy dawce 30 mg tiamazolu/dobę niektóre koty wykazywały oznaki niedokrwistości hemolitycznej i ciężkiego pogorszenia stanu klinicznego. Niektóre z tych objawów mogą również wystąpić u kotów z nadczynnością tarczycy leczonych dawkami do 20 mg tiamazolu na dobę.
Nadmierne dawki u kotów z nadczynnością tarczycy mogą powodować objawy niedoczynności tarczycy. Jest to jednak mało prawdopodobne, ponieważ niedoczynność tarczycy jest zwykle korygowana przez mechanizmy ujemnego sprzężenia zwrotnego. Patrz punkt 6: Działania niepożądane.
W przypadku przedawkowania należy przerwać leczenie i zastosować leczenie objawowe i podtrzymujące.
Niezgodności:
Ponieważ nie wykonywano braku badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
03/2024
15. INNE INFORMACJE
Butelka z oranżowego szkła typu III lub butelka z polietylenu o wysokiej gęstości (HDPE) zawierająca 30 ml, 50 ml lub 100 ml produktu, z zakrętką zabezpieczającą przed dostępem dzieci z polipropylenu (PP) oraz adapterem do strzykawki z polietylenu o niskiej gęstości (LDPE).
Strzykawka doustna 1,0 ml, z podziałką co 0,01 ml, składająca się z korpusu z polipropylenu (PP) oraz tłoka z polietylenu o wysokiej gęstości (HDPE) lub strzykawka doustna 1,5 ml, z podziałką co 0,05 ml, składająca się z korpusu z polietylenu o niskiej gęstości (LDPE) oraz tłoka z polistyrenu (PS).
Wielkość opakowań:
Pudełko tekturowe zawierające 1 butelkę o pojemności 30 ml i 1 strzykawkę doustną.
Pudełko tekturowe zawierające 1 butelkę o pojemności 50 ml i 1 strzykawkę doustną.
Pudełko tekturowe zawierające 1 butelkę o pojemności 100 ml i 1 strzykawkę doustną.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Wydawany z przepisu lekarza – Rp.
Do podawania pod nadzorem lekarza weterynarii.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego.
Poland
ScanVet Poland Sp. z o.o.
Skiereszewo, ul. Kiszkowska 9
62-200 Gniezno
Pozwolenie nr 3235/23